Цели урока:
- Обобщить и систематизировать знания учащихся по теме: “Периодический закон и периодическая система химических элементов Д.И Менделеева”,
- Закрепить умения учащихся в использовании периодического закона и ПСХЭ,
- Развивать познавательную активность учащихся, творческие способности, интерес к предмету,
- Пробудить чувство патриотизма, гордости, уважения к человеку, беззаветно служившему Родине, к его труду,
- Воспитать у ребят культуру поведения, культуру общения, толерантность.
Девиз урока: “Посев научный взойдет для жатвы народной” Д.И. Менделеев
Оборудование: ПСХЭ Д.И. Менделеева; портрет Д.И. Менделеева, портрет Д. Дальтона; плакат “Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются” Д.И. Менделеев”; таблица содержания химических элементов в организме человека; выставка литературы “Д.И. Менделеев- ученый химик”.
Реактивы: гидроксид цинка, гидроксид натрия, соляная кислота, вода, перманганат калия, железные опилки, древесный уголь, цинк.
Форма урока: Урок – конференция. Защита работ учащихся на звание “Магистр химии”.
Тип урока: Обобщение знаний по теме “Периодический закон и ПСХЭ Д.И. Менделеева”.
В ходе урока принимают участие все учащиеся. Каждый из докладчиков представляет свой вопрос совместно с ассистентом, который проводит демонстрации в подтверждение теоретической части выступления.
Работу учащихся оценивает “Ученый свет” в составе:
- Директор школы – Председатель “Ученого совета”
- Учитель химии – Ученый-химик
- Консультант – Ученик 9-uj класса
Предварительная подготовка:
Об уроке учащимся сообщается заранее, раскрываются цели и вопросы, которые будут озвучены в его ходе (обсуждаемые на нем). Оказывается помощь в поиске и подборе необходимой литературы, а также в подготовке ассистентов. Производятся соответственные меры по подготовке кабинета к мероприятию. Приглашаются члены жюри (“Ученого совета”). Оговаривается время выступления – 4-5 мин.
Содержание урока
- Вступительное слово учителя
- Защита мини-рефератов:
А) “Русский химик Д.И. Менделеев решил вопрос о классификации химических элементов”
Ассистент: Демонстрации по теме амфотерности соединения гидроксида цинка,
Б) “Научная деятельность Д.И. Менделеева – первая служба Родине”.
Ассистент: Викторина для слушателей.
В) “Вторая служба Родине – педагогическая деятельность Д.И. Менделеева”
Ассистент: Характеристика химического элемента по положению его в ПСХЭ.
Г) “Периодический закон Д.И. Менделеева – фундаментальный закон природы”
Ассистент: Биологическое значение химических элементов.
Д) Выступление “ученого-химика из г. Дубна” об открытии новых химических элементов и будущем ПСХЭ Д.И. Менделеева.
- Клятва юных “магистров химии”.
- Заключительное слово “Ученого совета”.
- Фейерверк успеха
Ход урока
Вступительное слово учителя:
Добрый день! Начинаем урок, который посвятим гениальному русскому ученому Д.И.Менделееву и его труду – Периодическому закону, выражением которого является ПСХЭ. По словам ученого, у него было “три службы Родине”: в научной деятельности он видел “первую службу”, “вторая служба” – педагогическая деятельность и “третья служба” – на ниве сельского хозяйства и промышленности.
Научным подвигом назвали открытие Д.И. Менделеевым периодического закона. Его появлением было положено начало новой эпохи в развитии химии и смежных наук – атомной физики, геохимии, химии космоса, а ПСХЭ стала “компасом”, “путеводной звездой” ученых в их исследовательской деятельности.
Сегодня на уроке нам представят свои выступления “кандидаты” на звание “магистр химии”, которые занимались изучением (исследованием) наследия, оставленным Д.И. Менделеевым в области создания периодического закона и ПСХЭ. Их работу оценивает компетентное жюри, которое на сегодняшнем занятии будет называться “Ученый совет”. В состав его входят: (происходит представление членов “Совета”, перед каждым из них на столе стоит соответствующая табличка – бейдж):
- Председатель “Ученого совета” – директор школы Серова В.Ф.;
- Ученый – химик – учитель химии Маркова Г.С.
- Консультант – ученик 9-го класса Титов А.
В заключении урока “Ученый совет” вынесет свое решение о присвоении звания. Регламент одного выступления составляет 4 минуты.
Слово предоставляется первому ученику.
Выступление 1. “Русский химик решил вопрос классификации химических элементов” Д.И. Менделеев родился в 1834 году в семье директора Тобольской гимназии. Рос очень любознательным. После окончания гимназии поступил в Петербургский педагогический институт. Здесь зародилась страсть к химии, были выполнены первые научные работы, и определился жизненный путь. Закончив институт с золотой медалью, Д.И. Менделеев, будучи преподавателем в Петербургском университете, вел курс химии. Важную роль в его жизни сыграла заграничная командировка: ученый присутствовал на Всемирном съезде химиков в г. Карлсруэ. На съезде Д.Дальтон выдвинул идею атомной массы, в результате “борьбы” были найдены способы определения относительных атомных масс, что предоставило Д.И. Менделееву необходимый материал для его исследований, для решения задачи – найти связь между элементами, которых известно на то время было всего 63.
Первые попытки классификации химических элементов сводились к разделению их по очевидным признакам простых веществ на металлы и неметаллы.
Вместе с тем, существовали простые вещества, проявляющие свойства металлов и неметаллов: неметалл по физическим свойствам имеет металлический блеск и электропроводность, но при нагревании сразу переходит в газообразное состояние, что несвойственно металлам.
Ассистент демонстрирует опыт по возгонке йода.
Кристаллический йод в закрытой колбе нагревается на пламени спиртовки, при этом колба заполняется газом фиолетового цвета, который при остывании кристаллизуется на стенках колбы в виде сверкающих частиц.
К таким же элементам, обладающим металлическими и неметаллическими свойствами, относится цинк. По физическим свойствам он – типичный металл (Докладчик демонстрирует цинк), но по химическим свойствам его гидроксид проявляет как основные (металлические), так и кислотные (неметаллические) свойства.
Ассистент демонстрирует опыт по амфотерности гидроксида цинка. В две пробирки помещают взвесь гидроксида цинка. В одну из них добавим соляную кислоту. Осадок растворится, что подтверждает основные свойства гидроксида цинка.
Zn (OH)2 + 2HCl => ZnCl2 + H2O.
В другую пробирку добавим раствор щелочи NaOH, в ней осадок тоже исчезнет, следовательно, гидроксид цинка проявляет кислотные свойства.
Zn (OH)2 – H2ZnO2
H2ZnO2 + 2NaOH => Na2ZnO2 + H2O.
Вывод: Гидроксид цинка амфотерен.
Из опытов видно, что классификация элементов на металлы и неметаллы является несовершенной, имеются переходные элементы.
Д.И. Менделеев решал задачу классификации химических элементов, принимая за основу их сравнения, увеличение относительной атомной массы. Расположив элементы в соответствии с массами, ученый заметил периодичность в изменении свойств элементов через некоторое их количество. В ряду, начинающимся активным щелочным металлом и заканчивающимся инертным газом, ослабевают металлические свойства; усиливаются неметаллические свойства; возрастает валентность по кислороду в оксидах; убывает (снижается) валентность неметаллов в водородных соединениях; изменяются свойства соединений от основных через амфотерные к кислотным. Такой ряд элементов был назван периодом.
Так, 1 марта 1869 г., был открыт периодический закон, который Д.И. Менделеев сформулировал следующим образом: “Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов”.
Выражением закона стала Периодическая система химических элементов, образом которой первоначально был “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”. На протяжении двух лет Д.И. Менделеев совершенствовал “Опыт системы”, в результате чего предсказал существование нескольких неизвестных тогда элементов: экаалюминия – галия, экабора – скандия, экасилиция – германия, аналога теллура – полония, налога йода – астата, налога цезия – франция и др. Были уточнены атомные массы урана, бериллия, индия, церия и др. Свои исследования ученый изложил в учебнике по химии “Основы химии”. Так русский ученый решил задачу классификации элементов. Его научные идеи и сегодня развиваются и претворяются в многочисленных трудах русских и зарубежных ученых.
В 1907 году Д.И. Менделеева не стало. Огромная толпа провожала его в последний путь, впереди несли его труд – ПСХЭ.

Выступление 2. “Научная деятельность Д.И.Менделеева – “первая служба Родине”
В 1955 г. американские физики во главе с Г. Сиборгом синтезировали химический элемент с порядковым номером 101. Они дали ему название “менделеевий” – в знак признания заслуг великого русского ученого. Периодическая система, созданная Д.И. Менделеевым, уже более 100 лет служит “ключом” к открытию новых элементов. Прав был ученый, говоря: “Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются”.
Периодический закон и система элементов Д.И. Менделеева стали важнейшим вкладом в развитие естествознания, но это лишь часть огромного наследия ученого. Полное собрание его сочинений – 25 объемистых томов, настоящая энциклопедия знаний, в них свыше 500 печатных трудов.
Д.И. Менделеев привел в систему сведения об изоморфизме, и это сыграло роль в развитии геохимии. Он открыл критическую температуру кипения, выше которой вещество не может находиться в жидком состоянии, разработал гидратную теорию растворов и тем самым по праву считается выдающимся физиком – экспериментатором. Ученый предложил промышленный способ фракционного разделения нефти, разработал процесс приготовления бездымного пороха. Изучал воздухоплавание, метеорологию, совершенствовал технику измерений. Будучи управляющим Главной палаты мер и весов, много сделал для развития метрологии (в настоящее время ВНИИ метрологии имени Д.И. Менделеева). Он – один из инициаторов создания Русского химического общества в 1868г. (в настоящее время Российское химическое общество имени Д.И. Менделеева).
За свои научные заслуги Д.И. Менделеев был избран членом более 50 академий и научных обществ разных стран. В научной деятельности ученый видел, по его словам, свою “первую службу Родине”.
Ассистент предлагает проверить знание химических элементов ПСХЭ Д.И. Менделеева, ответив на вопросы викторины:
- Какой русский ученый первым в России совершил перелет на воздушном шаре? (Д.И. Менделеев)
- Какой химический элемент может “родить” воду? (Водород)
- Какой элемент утверждает, что он – это не он? (Неон)
- Какой элемент всегда рад? (Радий)
- Какой элемент и сосновый лес имеют одно имя? (Бор)
- Название какого элемента начинается с маленького грызуна, а заканчивается большим быком? (Мышьяк)
- Название какого элемента входит в название супа из свеклы и капусты? (Борщ – Бор)
- Используя первую букву названного животного, назовите элемент, начинающийся с этой буквы:
| Куница – калий Соболь – сера Белка – барий |
Норка – натрий Кабан – кобальт Бобр – берилий |
Горностай – галий Выхухоль – вольфрам Ондатра – олово |
- Какой русский химик в свободное время увлекался изготовлением чемоданов? (Д.И. Менделеев)
Выступление 3. “Вторая служба Родине – педагогическая деятельность Д.И. Менделеева”.
Д.И. Менделеев окончил Петербургский педагогический институт и занимался преподавательской деятельностью во многих учебных заведениях г. Петербурга. Он говорил: “Из тысяч моих учеников много теперь повсюду видных деятелей, и, встречая их, всегда слышал, что доброе в них семя полагал, а не простую отбывал повинность”. Он был автором учебника “Основы химии”, который при его жизни выдержал 6 изданий и не раз переводился на иностранные языки. Д.И. Менделеев – профессор Петербургского университета (1865 – 1890 г.) ушел в отставку в знак протеста против притеснения студентов. С 1876 г. он – член-корреспондент Петербургской Академии наук. Ученый был одним из образованнейших, культурнейших людей своего времени. Он интересовался литературой и искусством, собрал огромную коллекцию картин художников разных стран и народов. На его квартире часто проходили встречи выдающихся деятелей культуры того времени. “Посев научный взойдет для жатвы народной” – таков был девиз всей деятельности ученого.
Обучаясь сегодня наследию Д.И. Менделеева, мы должны знать и периодический закон, и периодическую систему элементов, выполняя завет великого педагога.
Ассистент дает характеристику одному из химических элементов по его положению в ПСХЭ.
Кислород О – (оксигениум – рождающий кислоты), стоит на 8-ом месте, это значит, что в его ядре находится 8 протонов, а вокруг ядра вращаются 8 электронов. Относительная атомная масса 16, это значит в ядре, кроме 8 протонов могут содержаться 8 нейтронов. Элемент имеет изотопы.
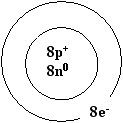
Элемент стоит во 2-ом периоде, значит, его оболочка имеет 2 энергетических уровня: на первом – 2 электрона, на втором – 6 электронов. Он занимает место в 6-ой группе в главной подгруппе, значит, в наружном слое двигается 6 электронов, наружный слой незавершен, до его завершения не хватает 2-х электронов, поэтому в химических соединениях кислород принимает 2 электрона, превращаясь в отрицательный ион со степенью окисления -2, проявляя окислительные свойства.
![]() , окислитель. В наружном
слое 2 электрона двигаются в шарообразном облаке,
и 4 электрона – в трех гантелеобразных облаках,
одно из которых является спаренным.
, окислитель. В наружном
слое 2 электрона двигаются в шарообразном облаке,
и 4 электрона – в трех гантелеобразных облаках,
одно из которых является спаренным.
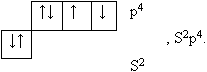
Электроны в не спаренных облаках способны образовывать общие электронные пары с менее электроотрицательными элементами. Кислород – сильный окислитель, он может проявлять восстановительные свойства только в соединении с фтором. О+6F-16, с остальными элементами он образует оксиды. Кислород также образует два простых вещества – кислород О2 и озон О3. Имеет водородное соединение H2O – вода.
Выступление 4. “Периодический закон Д.И. Менделеева – фундаментальный закон природы”.
Периодический закон химических элементов отражает периодическое изменение свойств элементов по мере увеличения относительной атомной массы, но масса элемента может изменяться с изменением количества нейтронов в ядре у изотопов. Например, водород имеет три вида изотопов: с массой – 1 (легкий водород), с массой -2 (дейтерий), с массой -3 (тритерий). Вид атомов с одинаковым зарядом ядра называют “химическим элементом”. Периодичность в изменении свойств химических элементов зависит от заряда атомного ядра. Но Д.И. Менделеев тогда еще этой зависимости не знал, составляя таблицу элементов, которая называлась “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”. Окончательная формулировка периодического закона была им дана в 1871 г. Она гласила: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от их атомного веса”. Менделеевская формулировка прослужила науке 40 лет. Она была пересмотрена благодаря выдающимся достижениям физики в разработке ядерной модели атома, открытия изотопов у элементов. Теперь формулировка звучит следующим образом: “Свойства химических элементов и их соединений находятся в периодической зависимости от заряда атомных ядер”.
В отличие от других законов природы, периодический закон не может быть записан в виде математической модели – формулы или уравнения. Его наглядным изображением является система химических элементов. Периодический закон – универсальный закон для всей Вселенной, он имеет силу везде, где есть атомы химических элементов.
Ассистенты представляют перед слушателями ряд химических элементов, которые играют огромную роль в развитии человека:
С – Углерод. Считается “царем” живой природы, хотя в природе его находится всего 0,35%. Из истории эволюции на Земле известно, что жизнь возникла из комочков углеродистой слизи. В организме человека его приблизительно 21%. Вместе с кислородом, азотом и водородом он составляет основу нашего организма.
О – Кислород. Основной окислитель в нашем организме. Является одним из составляющих воды, его содержание равняется приблизительно 62%. Исключительно важна роль кислорода в процессе дыхания, в осуществлении окислительно-восстановительных процессов, происходящих в клетках организма. Кислород вездесущ. В атмосфере его содержание составляет около 21%, в гидросфере – 80%, в биосфере – 62%, в литосфере – 49%.
N – Азот. Жизненно важный элемент. Все основные части клеток тканей организмов построены из белковых молекул, в состав которых входит азот. Без белка нет жизни, без азота нет белка. В организме человека его приблизительно 3%. Кроме того, человек живет в азотной среде, так как содержание азота в воздушной атмосфере составляет около 78%.
P – Фосфор. Основная составляющая часть тканей организма животных и растений, входит в состав костей, нервной и мозговой тканей, крови, белков. Из фосфора в организме человека строится АТФ – аденозинтрифосфорная кислота, которая является носителем и собирателем, аккумулятором энергии. Она необходима для полноценного функционирования печени, мышц, мозга. Академик А.Е. Ферсман назвал фосфор элементом “жизни и мысли”. В организме человека его содержание составляет около 1%.
Ca – Кальций. Материал для постройки костных скелетов. Он играет существенную роль в процессах жизнедеятельности: регулирует работу сердца, участвует в процессе свертывании крови. На долю кальция приходится около 1,5% массы тела человека, из них 98% содержатся в костях, в костных тканях организма. По расчетам, проведенным на уроках химии в 9 классе, в организме каждого девятиклассника содержится около 2кг солей кальция и 800г непосредственно самого кальция.
Выступление 5. Будущее периодического закона и периодической системы элементов.
(Выступает химик-экспериментатор из г. Дубна)
Наследие Д.И. Менделеева пополняется и развивается и в наши дни. Конечное число элементов в ПСХЭ пока не определено. Проблема ее верхней границы – основная задача химиков. Из 110 общеизвестных химических элементов обнаружено в природе 88. Самый тяжелый элемент, который непосредственно существует в природе – это плутоний № 94. Остальные элементы получены искусственно. Способ получения элементов искусственным путем – ядерный синтез. С его помощью уже синтезированы элементы № 110, № 111, а в 2006 году российским химикам удалось создать элемент № 113. Он был получен в г. Дубна Московской области , планируется назвать его “дубний”.
С помощью ЭВМ ученые пытались определить строение атомов и свойства “сверхэлементов” с № 172- № 184. результаты оказались неожиданным. Например, в атоме элемента № 121 предполагается появление 8р – электронов. Расчеты показывают, что у элементов гипотетического восьмого периода заполнение электронных оболочек атомов происходит в очень сложной последовательности. Восьмой период должен содержать около 50 элементов (№ № 119-168), а девятый – всего 8 элементов.
Периодическая система Д.И. Менделеева сыграла огромную роль в развитии различных областей естествознания. Она явилась важнейшим достижением атомно-молекулярного учения, способствовала появлению понятия “химический элемент”, а также уточнению понятий простых и сложных веществ. С нею связана проблема прогнозирования в химии. Она является фундаментом неорганической химии, помогает решать задачи химического синтеза веществ с заданными свойствами: новых катализаторов, полупроводников и др. Кроме того, ПСХЭ лежит в основе преподавания химии.
Учитель. Мы выслушали все представленные выступления “очень молодых ученых”, а также посмотрели наглядные материалы. “Ученый совет” подводит сейчас итоги нашей научной конференции, оценивает выступления “кандидатов”. Прошу всех докладчиков на сцену. Вам предстоит еще одно, последнее испытание – клятва юного химика. (Учитель читает вслух текст клятвы, учащиеся – докладчики повторяют):
“Я – юный химик, клянусь:
Горячо любить уроки химии,
Помнить химические свойства любого вещества,
Знать все 110 химических элементов,
Порошкообразные вещества не просыпать,
Жидкие – не проливать,
Газообразные – не выпускать из емкостей наружу,
Не тратить зря спирт в спиртовке.
Жить, учиться и “химичить”, как завещал великий Менделеев”.
Слово предоставляется “Ученому совету”. Члены совета кратко рецензируют, дают оценку прослушанным выступлениям, вручают свидетельства “Магистров химии”, награждают учащихся, поздравляют. Учитель сообщает оценки.
В честь новых “ученых” производится фейерверк: смесь перманганата калия, древесного угля и порошкообразного железа поместить в металлический наперсток и внести в пламя спиртовки.
Урок окончен.